A Piper-diagram alapelvei és jelentősége a hidrogeokémiában

A Piper-diagram, más néven háromszögdiagram vagy Trilinear-diagram, a hidrogeokémia egyik alapvető és széles körben alkalmazott grafikus ábrázolási módszere. Létrehozása Arthur M. Piper nevéhez fűződik, aki az 1940-es években fejlesztette ki ezt a hatékony eszközt a vízben oldott fő ionok (kationok és anionok) relatív koncentrációjának vizuális megjelenítésére és a különböző vízminták geokémiai típusainak osztályozására. A Piper-diagram kiemelkedő jelentőséggel bír a vízminőség értékelésében, a vízforrások eredetének és evolúciójának megértésében, valamint a vízszennyezés forrásainak és terjedésének azonosításában. Alkalmazása lehetővé teszi a komplex hidrogeokémiai adatok egyszerű és áttekinthető formában történő megjelenítését, megkönnyítve ezzel a különböző vízminták közötti hasonlóságok és különbségek feltárását, valamint a hosszú távú vízminőségi trendek nyomon követését.
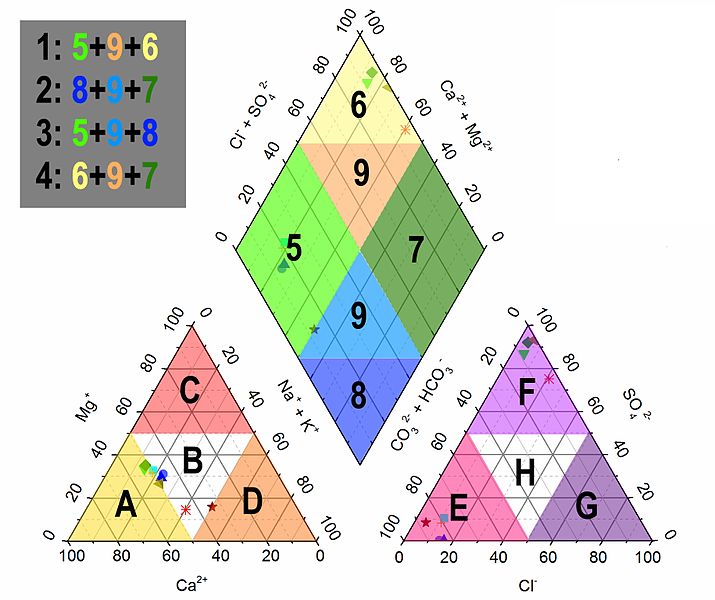
A diagram alapját két háromszög alakú mező képezi, amelyek egy rombusz alakú mezőhöz kapcsolódnak. A bal oldali háromszög a fő kationok (általában kalcium (\\mathbf\{Ca^\{2\+\}\}), magnézium (\\mathbf\{Mg^\{2\+\}\}) és nátrium plusz kálium (\\mathbf\{Na^\{\+\} \+ K^\{\+\}\})) százalékos arányát ábrázolja. A jobb oldali háromszög hasonlóképpen a fő anionok (általában bikarbonát plusz karbonát (\\mathbf\{HCO\_3^\{\-\} \+ CO\_3^\{2\-\}\}), szulfát (\\mathbf\{SO\_4^\{2\-\}\}) és klorid (\\mathbf\{Cl^\{\-\}\})) százalékos arányát mutatja be. Az egyes vízminták ionösszetételének megfelelő pontokat mindkét háromszögben bejelölik. Ezután ezeket a pontokat a rombusz alakú mezőbe vetítik, ahol a kationok és anionok együttes összetételét reprezentáló pont jön létre. A rombusz mezőben elhelyezkedő pontok klasztereződése vagy szóródása értékes információkat nyújt a vizsgált vízminták geokémiai jellemzőiről és azok lehetséges kapcsolatairól.
A Piper-diagram felépítése és a tengelyek jelentése

A Piper-diagram strukturális felépítése kulcsfontosságú a helyes értelmezéshez. A diagram két ekvilibrilis háromszögből áll, amelyek egy közös alappal rendelkeznek, és egy rombusz alakú mezőt alkotnak közöttük. Mindkét háromszög csúcsai a vizsgált fő ionok 100%-os relatív koncentrációját képviselik. A bal oldali háromszög csúcsai a kalcium (\\mathbf\{Ca^\{2\+\}\}), a magnézium (\\mathbf\{Mg^\{2\+\}\}), valamint a nátrium és kálium együttes (\\mathbf\{Na^\{\+\} \+ K^\{\+\}\}) ionoknak felelnek meg. A jobb oldali háromszög csúcsai pedig a bikarbonát és karbonát együttes (\\mathbf\{HCO\_3^\{\-\} \+ CO\_3^\{2\-\}\}), a szulfát (\\mathbf\{SO\_4^\{2\-\}\}) és a klorid (\\mathbf\{Cl^\{\-\}\}) ionok relatív arányát jelölik.
Az egyes háromszögekben a tengelyek úgy vannak beosztva, hogy bármely belső pont a három csúcsnak megfelelő ionok százalékos arányát egyértelműen meghatározza. A pont helyzete a háromszögön belül azt mutatja meg, hogy az adott vízmintában melyik kation vagy anion dominál, illetve milyen a fő ionok relatív eloszlása. Például, egy a kalcium csúcsához közeli pont azt jelzi, hogy a kalciumion a domináns kation az adott vízmintában. Hasonlóképpen, a jobb oldali háromszögben egy a bikarbonát csúcsához közeli pont a bikarbonát dominanciáját tükrözi.
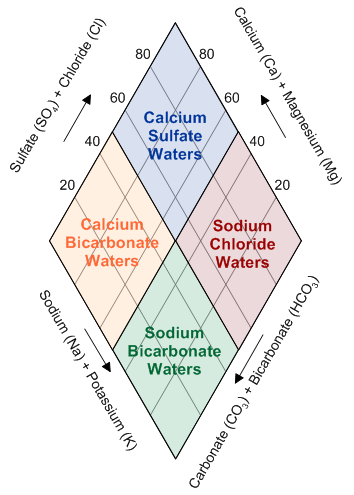
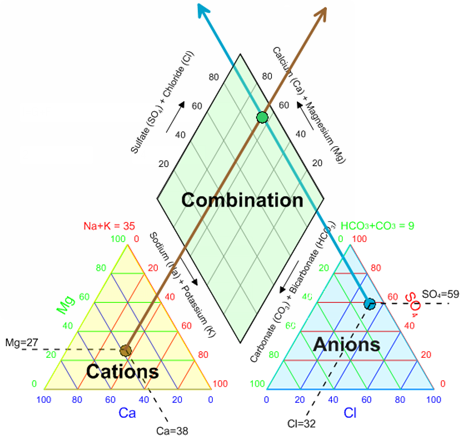
A rombusz alakú mező a két háromszögből származó információk kombinációját jeleníti meg. Az egyes vízminták pontjait a háromszögekből a rombuszba vetítik úgy, hogy a kationok relatív arányait a bal oldali háromszögből, az anionok relatív arányait pedig a jobb oldali háromszögből veszik figyelembe. A rombusz vízszintes tengelye a alkaliföldfémek (kalcium és magnézium) és az alkáli fémek (nátrium és kálium) relatív arányát tükrözi. A függőleges tengely pedig a gyenge savak (bikarbonát és karbonát) és az erős savak (szulfát és klorid) relatív arányát mutatja. A rombuszban elhelyezkedő pontok klasztereződése vagy diszperziója alapján következtetéseket lehet levonni a vizsgált vízminták közötti geokémiai kapcsolatokra és a vízminőség általános jellemzőire.
A kationháromszög értelmezése: \\mathbf\{Ca^\{2\+\}\}, \\mathbf\{Mg^\{2\+\}\}, \\mathbf\{Na^\{\+\} \+ K^\{\+\}\} arányok
A Piper-diagram bal oldali, kationokat ábrázoló háromszöge alapvető információkat nyújt a vízben található pozitív töltésű ionok relatív mennyiségéről. A három csúcs, amelyek a kalcium (\\mathbf\{Ca^\{2\+\}\}), a magnézium (\\mathbf\{Mg^\{2\+\}\}) és a nátrium plusz kálium (\\mathbf\{Na^\{\+\} \+ K^\{\+\}\}) ionokat képviselik, meghatározzák a háromszög belső pontjainak jelentését. Egy adott vízminta pontjának elhelyezkedése ebben a háromszögben azt mutatja meg, hogy a teljes kationkoncentráció hány százalékát teszi ki az egyes ioncsoport. Például, ha egy pont a kalcium csúcsához közel helyezkedik el, az azt jelenti, hogy a kalciumionok dominálnak a kationösszetételben.
A háromszög oldalvonalai és belső területei a kationok relatív arányainak különböző kombinációit jelölik. A háromszögön belül kijelölhetők olyan területek, amelyek bizonyos kationtípusok dominanciáját vagy kiegyenlített arányát képviselik. Például, a háromszög középső része olyan vízmintákat reprezentálhat, ahol a kalcium, a magnézium, valamint a nátrium és kálium ionok relatív aránya hasonló. Ezzel szemben a csúcsokhoz közeli területek egyértelműen egy-egy kationtípus túlsúlyát jelzik.
A kationháromszög elemzése különösen fontos a víz keménységének megértésében. A kalcium és a magnézium ionok felelősek a víz karbonátos és nem karbonátos keménységéért. A magas kalcium- és magnéziumtartalmú vizek általában kemények, míg a nátrium- és káliumdomináns vizek lágyabbak lehetnek. A diagramon a pontok elhelyezkedése segíthet azonosítani azokat a vízmintákat, amelyek potenciálisan kemények vagy lágyak, és következtetéseket lehet levonni a víz geológiai környezetére és a vízkőlerakódás kockázatára.
A magnézium és kalcium relatív arányának jelentősége
A magnézium (\\mathbf\{Mg^\{2\+\}\}) és a kalcium (\\mathbf\{Ca^\{2\+\}\}) relatív aránya a vízben számos geokémiai folyamatra és a víz minőségére is jelentős hatással van. Ez az arány tükrözheti a víz eredetét, a kőzetekkel való kölcsönhatás mértékét, valamint a víztározó geológiai összetételét. Például, a dolomitos kőzetek oldódása a kalciumhoz képest magasabb magnéziumkoncentrációt eredményezhet a vízben. Ezzel szemben a mészkő oldódása a kalcium dominanciájához vezethet.
A \\mathbf\{Mg^\{2\+\}/Ca^\{2\+\}\} arány fontos indikátor lehet a talajvíz és a felszíni víz közötti kölcsönhatások vizsgálatában is. A különböző víztípusokra jellemző eltérő arányok segíthetnek a keveredési folyamatok azonosításában és a vízforrások eredetének nyomon követésében. Emellett az ipari tevékenységek vagy a mezőgazdasági befolyás is megváltoztathatja ezt az arányt, így annak monitorozása a szennyezés nyomon követésében is hasznos lehet.
A vízhasználat szempontjából a magnézium és kalcium aránya befolyásolhatja a víz keménységét és a vízkőlerakódás mértékét a csővezetékekben és a háztartási gépekben. A magas keménységű víz, különösen ha a kalcium dominál, nagyobb valószínűséggel okoz vízkőképződést. A magnézium jelenléte szintén hozzájárul a keménységhez, de a kalciumhoz képest eltérő módon befolyásolhatja a vízkő szerkezetét és oldhatóságát. A Piper-diagram kationháromszögének elemzése lehetővé teszi a különböző vízminták magnézium-kalcium arányának összehasonlítását és a vízhasználattal kapcsolatos potenciális problémák előrejelzését.
A nátrium és kálium együttes arányának jelentősége
A nátrium (\\mathbf\{Na^\{\+\}\}) és a kálium (\\mathbf\{K^\{\+\}\}) együttes koncentrációja, a Piper-diagram kationháromszögének harmadik csúcsát képviselve, szintén fontos információkat hordoz a víz geokémiai jellemzőiről. Bár a kálium koncentrációja a legtöbb természetes vízben általában sokkal alacsonyabb, mint a nátriumé, a \\mathbf\{Na^\{\+\} \+ K^\{\+\}\} együttes arányának vizsgálata segíthet a különböző vízforrások azonosításában és a víz evolúciójának megértésében.

A magas nátriumtartalom gyakran a sókőzetek oldódására, a tengeri behatolásra a part menti területeken, vagy antropogén hatásokra, például útszóró só használatára vezethető vissza. A kálium koncentrációja általában a földpátok és más szilikátásványok mállásával növekszik, de a mezőgazdasági tevékenységből származó műtrágyák is hozzájárulhatnak a káliumtartalom emelkedéséhez bizonyos esetekben.
A \\mathbf\{Na^\{\+\}/\(Na^\{\+\} \+ Ca^\{2\+\}\)\} arány, más néven szódiumadszorpciós arány (SAR), különösen fontos a mezőgazdasági öntözővíz minőségének megítélésében. A magas SAR értékű víz károsíthatja a talaj szerkezetét, csökkentheti annak permeabilitását és nehezítheti a növények vízfelvételét. A Piper-diagram kationháromszögének elemzése lehetővé teszi az öntözésre szánt vizek nátriumtartalmának és a SAR értékének gyors becslését, segítve ezzel a fenntartható vízgazdálkodási gyakorlatok kialakítását.
Az anionháromszög értelmezése: \\mathbf\{HCO\_3^\{\-\} \+ CO\_3^\{2\-\}\}, \\mathbf\{SO\_4^\{2\-\}\}, \\mathbf\{Cl^\{\-\}\} arányok
A Piper-diagram jobb oldali, anionokat ábrázoló háromszöge a vízben található negatív töltésű ionok relatív mennyiségét szemlélteti. A három csúcs a bikarbonát és karbonát együttes (\\mathbf\{HCO\_3^\{\-\} \+ CO\_3^\{2\-\}\}), a szulfát (\\mathbf\{SO\_4^\{2\-\}\}) és a klorid (\\mathbf\{Cl^\{\-\}\}) ionokat képviseli. Az ebben a háromszögben elhelyezkedő pontok az egyes anioncsoportok százalékos arányát mutatják a teljes anionkoncentráción belül.
A bikarbonát és karbonát ionok koncentrációja szoros összefüggésben áll a víz pH-értékével és a karbonátos kőzetek oldódásával. A magas bikarbonát-tartalom gyakran lúgos kémhatású vizekre jellemző. A szulfátionok forrásai lehetnek a szulfidos ásványok mállása, a gipsz vagy anhidrit oldódása, valamint ipari és mezőgazdasági szennyezések. A kloridionok koncentrációja növekedhet a sókőzetek oldódása, a tengeri behatolás vagy a szennyvíz bevezetése következtében.
Az anionháromszög elemzése segít a víz geokémiai típusának azonosításában és a különböző vízminták közötti hasonlóságok és különbségek feltárásában. Például, egy a bikarbonát csúcsához közeli pont kalcium-bikarbonátos vízre utalhat, amely gyakran a karbonátos kőzetekkel való kölcsönhatás eredménye. Egy szulfátban gazdag víz szulfátos kőzetekkel vagy szennyezéssel lehet összefüggésben, míg a kloriddomináns víz sókőzetekkel vagy tengeri hatással magyarázható.